研究テーマ
Research Subject
普遍的な時間を制御する体内時計
体内時計:動的恒常性を担う
「健康の原理」
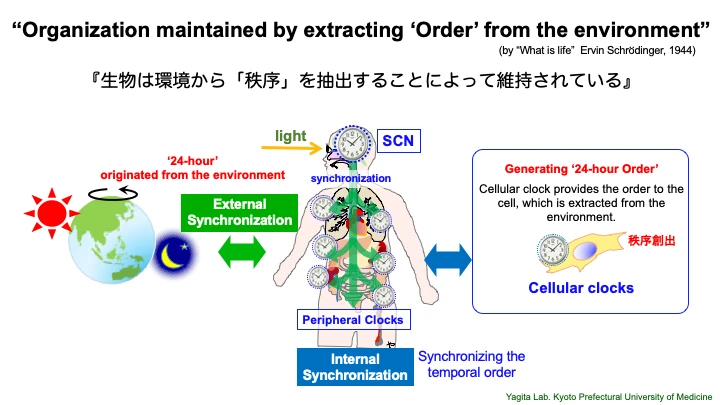
生物だけが持つ「時間を操るしくみ」から健康の原理に迫る
エルヴィン・シュレーディンガーは名著「生命とは何か」の中で、「生物は環境から秩序を抽出することで生命を維持しうる」と述べています。全身の細胞に備わる体内時計は、地球の自転周期という普遍的な時間単位を基準として、生体に「秩序」を生み出しています。例えば、代謝ひとつとっても、細胞の中で多数の化学反応が同時に進んでいますが、この代謝ネットワーク全体に体内時計の制御が及んでいるのです。これによって、健康な細胞では、多数の化学反応の集合体として極めて秩序だった状態を維持できているのです。
このように、環境適応と恒常性維持を両立させる生物の基本原理が、体内時計による概日リズム(サーカディアン・リズム)制御です。そしてその原理は、もちろん、私たちヒトにも備わり、健康の基盤となる生理機能を司っています。しかし、意外にも、不規則な生活がなぜ健康に悪いのか、体内時計がどのように私たちの健康を制御しているのか、そのメカニズムはほとんどわかっていないのです。
さらに、生物種に共通の「体内時計」に加え、生物は種に固有の「時間」を厳密に制御しています。発生過程に見られるさまざまなイベントのタイミング制御がそうです。哺乳類の妊娠期間は、種によって決まっています。個体間のばらつきは驚くほど小さく、厳密な時間スケールの制御原理の存在を暗示します。
私たちは、生物だけが持つ「時間の操り方」を研究しています。「種固有の時間」と「普遍的な時間」これらを巧妙に操って私たちはこの地球上に生きることができ、また健康であることができます。
(1)発生発達:「種固有の時間」と「普遍的な時間」を操る生命
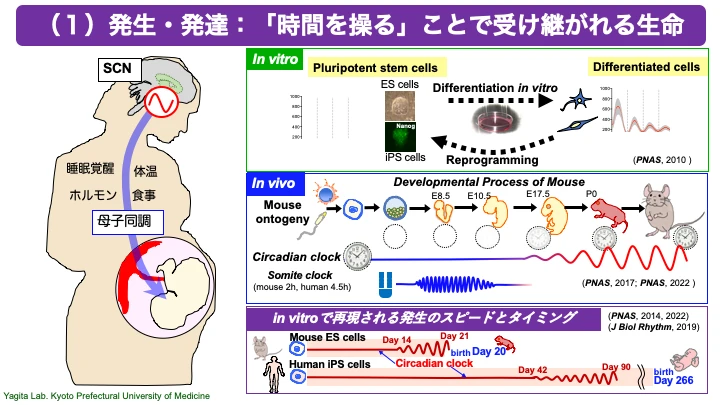
○『すべては概日時計(体内時計)発生のin vitro再現から始まった』
哺乳類では、視交叉上核が概日リズムの中枢であり、中枢時計と呼ばれます。一方、体内時計は、視交叉上核のみならず全身のほとんどの細胞にも存在します。私たちは、培養細胞にも視交叉上核と同様に遺伝的に規定された体内時計がが備わっていることを明らかにしました(Yagita et al, Science, 2001)。
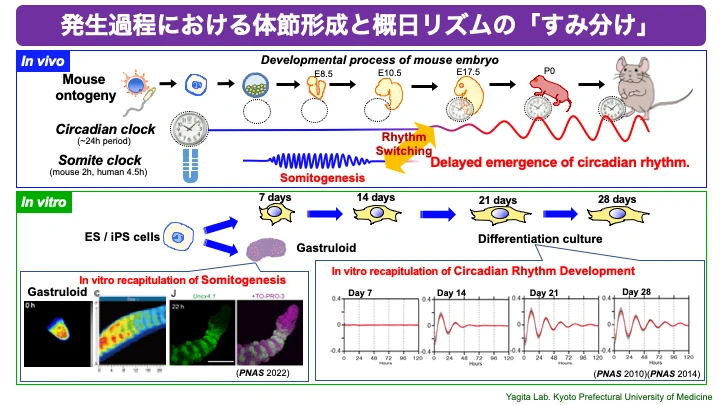
さらに私たちは、i)多能性幹細胞であるES細胞やiPS細胞には体内時計のリズムが見られないことを明らかにし、しかも、ii)ES細胞やiPS細胞をin vitro(試験管内)で分化させることで細胞自律的に体内時計が形成されていくこと、iii)さらに分化した細胞をもう一度リプログラミングし未分化状態のiPS細胞に戻すことで体内時計が再び消失すること、を発見しました(Yagita et al, PNAS, 2010)。私たちの一連の研究により「体内時計と細胞分化のリンク」というこれまで知られていなかった普遍的な細胞機能が明らかとなり(PNAS, 2014;PNAS, 2017; Sci Rep, 2019など)、発生学のみならずがんやオルガノイド研究など多岐にわたる研究分野に新たな視点を提供しています。
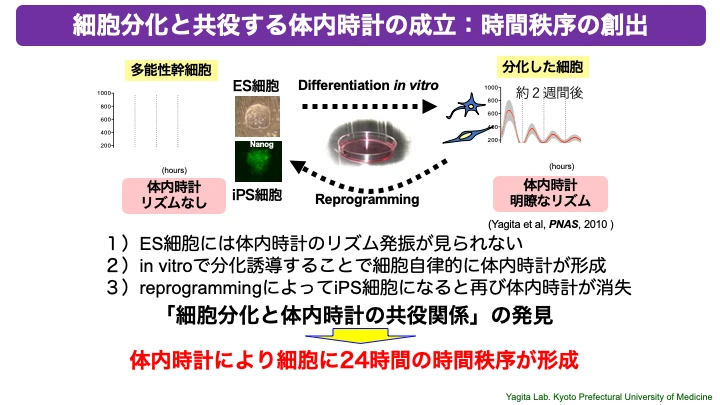
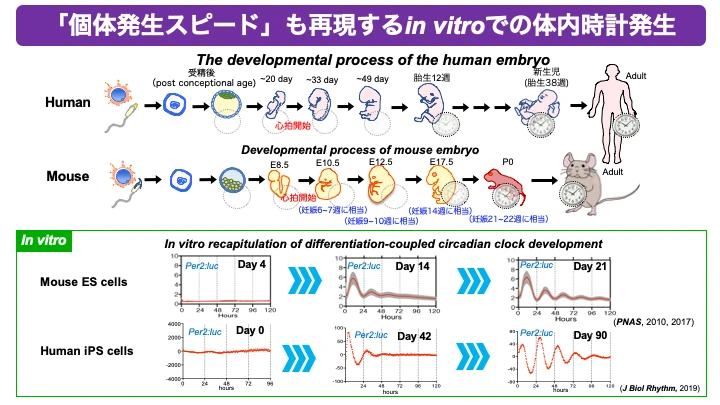
○「種固有の発生スピード」も再現するin vitroでの体内時計発生
発生のスピードは種によって大きく異なります。しかし、その種の中では個体間の発生スピードは驚くほど正確に揃っています。当たり前、でしょうか?誰もが知ることですが、「種によって発生スピードは違う」「同じ種の個体間で発生スピードは同じ」、という事実に私たちは注目しています。そのきっかけは、ES/iPS細胞の分化誘導系を活用して、概日時計(体内時計)発生のin vitro再現を世界で初めて成功させたことです(PNAS, 2010)。ヒトのiPS細胞とマウスのES / iPS細胞では、分化誘導培養による体内時計の形成スピードが大きく異なります(J. Biol. Rhythm, 2019)。しかも、体内時計の形成スピードは、個体発生スピードと驚くほど一致していました。「個体発生のスピードが細胞にプログラムされている」という、それまで想像もしていなかった概念が、明確に仮説として提示された瞬間でした。
生物種によって発生スピードが異なることは「異時性(heterochrony)」の一種として知られていますが、この生物における時間のスケーリングという根本的な原理がin vitroで再現可能であるという観点は、発生発達プログラムの核心となる「時間の操作」において非常に重要な手掛かりとなると考えています。我々が挑戦する大きなテーマ『生物はなぜ時間を操ることができるのか?』は、私たち人間が健康に生きることにも通じる「生物観」の創出につながる研究です。
○体内時計発生の「タイミング制御」の解明
概日リズムを制御する体内時計に加え、ガストロイド(gastruloids)という胚オルガノイドによる体節形成のin vitro再現系を用い、発生過程を通して体節時計(分節時計)による秩序から体内時計の時間秩序への劇的な周波数転換が生じること明らかにしました(PNAS, 2022)。哺乳類発生プロセスにおける重要イベントの「時間的すみ分け」は、正常な個体発生に必須である可能性が示唆されたことから、重要イベントの『タイミング制御』メカニズムは、生物の種の存続においても不可欠な原理と考えられます。我々は、体節形成、器官形成、体内時計や心拍などリズム形成、などの個々の重要イベントを時間的に統合する動作原理の解明を目指しています。
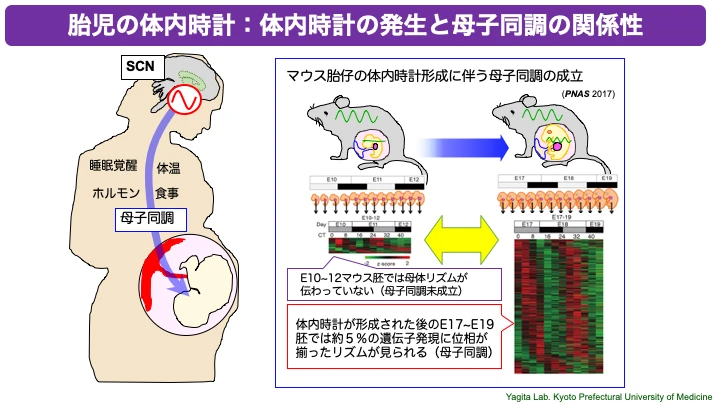
○母子間コミュニケーションの「タイミング制御」の原理解明
概日リズムの発生発達では、胚や胎児の体内時計だけでなく、母体との関係も非常に重要です。「母子同調」と呼ばれる概日リズムの母子間の同調は、胎児発生や生後発達に無視できない影響があるとの報告もあります。しかし、母子同調の実態はよくわかっていない点も多く、体系的な理解には至っていません。我々は、体内時計が未形成のマウス胚(E10〜12)では母子同調が未形成で母体の概日リズムによる同調・引き込み現象がほとんど見られないことを報告しました(PNAS, 2017)。これは、発生過程においてある時点までは母子同調が生じていないことを示すもので、体温リズムやグルココルチコイドなどリズム同調因子による母子同調の成立メカニズムの解明は我々の重要なテーマとなっています。
(2)老化と寿命:縦断的研究モデルによる病態再現
我々は、世界的にも限られた研究室でしか実施できない超長期の環境タスクによる概日リズム研究「マウスコホート」モデルを駆使して、老化や寿命の制御機構、さらに加齢と関連する生活習慣病やフレイルなどの病態発症メカニズムの解明を目指しています。このように、我々は、体内時計・概日リズムを切り口とした「老化と寿命・加齢性疾患のリスク予測と予防」の基盤となる動的恒常性原理の理解に向けた研究を展開しています。
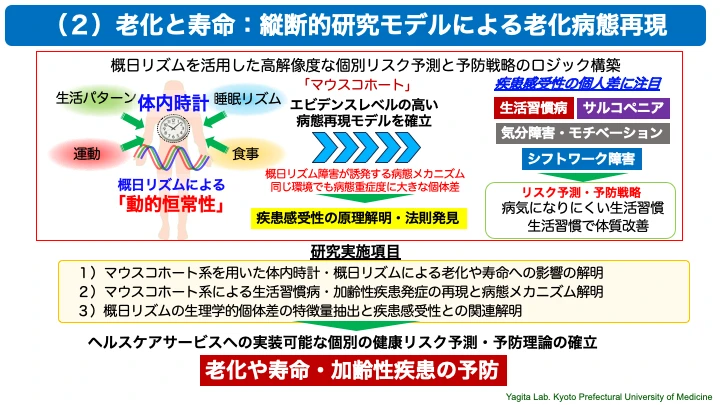
○マウスコホート系を用いた体内時計による老化や寿命への影響の解明
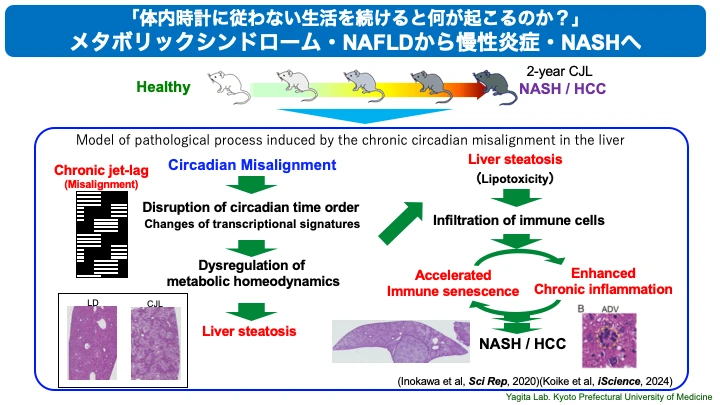
体内時計は、老化や寿命と非常に密接に関連することがわかってきています。我々は、「マウスコホート」と名付けた長期にわたる前向き観察研究の動物実験モデルを確立しました。さまざまな明暗サイクル環境条件下で1〜2年にわたってマウスの活動リズムや体重などの生理機能を個体ごとの計測し、寿命やさまざまな臓器における病態を解析します。シフトワークモデルとしても有用で、明暗シフト環境による概日リズム障害の自然発症を再現する実験系としても貴重なデータを提供しています。これまでに、我々の研究から、自分の体内時計から大きくかけ離れた生活を長期間にわたって送ることで、寿命の短縮や慢性炎症・免疫老化の促進等が見られることがわかりました(Sleep Biol Rhythm, 2017)(Sci Rep, 2020)。このような、「マウスコホート」モデルは、ヒトで見られる慢性疾患や生活習慣病の病態研究において「よくデザインされた動物を用いた縦断的研究モデル」としてエビデンスレベルの高い重要な研究モデルの一つとして注目が高まっています。
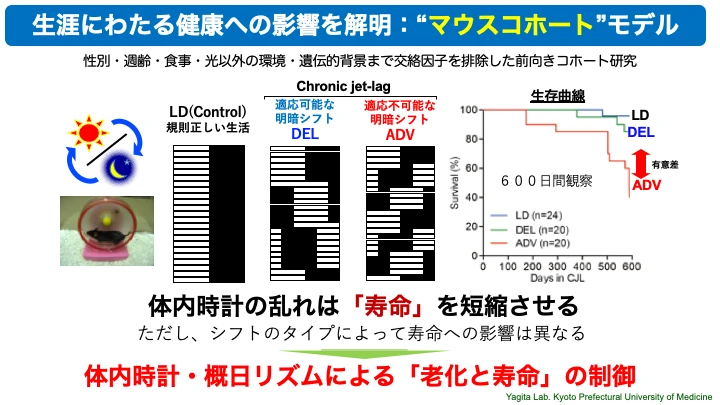
○体内時計の適応不全環境による生活習慣病・加齢性疾患の発症再現と病態メカニズム解明
我々のマウスコホート研究によって得られた明暗シフト暴露実験の結果は、体内時計が長期にわたり乱れ続けることでMASLD(Metabolic dysfunction Associated Steatotic Liver Diseases:代謝異常関連脂肪性肝疾患)やMASH(Metabolic dysfunction Associated Steatohepatitis:代謝異常関連性脂肪肝炎)、肝細胞がんの発症リスクとなることを明らかにしたもので、ヒトの概日リズム障害の病態を再現していることを明確に示したエビデンスとして注目されています(Sci Rep, 2020)。
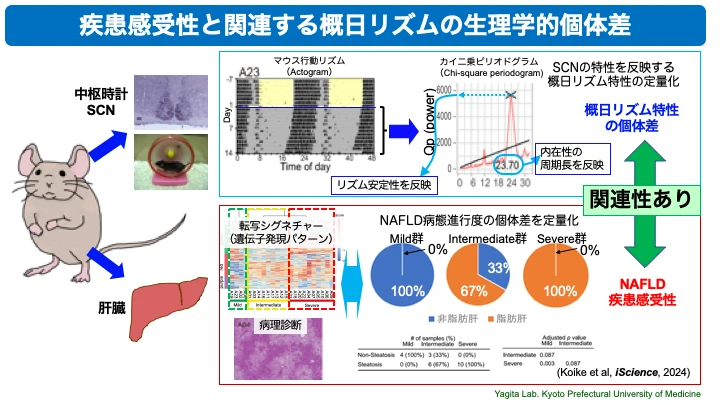
○概日リズムの生理学的個体差の指標抽出と疾患感受性との関連解明
さらに、明暗シフト環境に暴露したマウスは脂肪肝の発症が有意に増加するのですが、興味深いことに同一の明暗シフト環境で飼育したマウス間でも肝臓の組織がほとんど正常な個体と重度の脂肪肝を発症している個体が見られることがわかりました。「個体差」がどのようなメカニズムで生じるのかを検討したところ、それぞれのマウスがもともと持つ行動リズム特性が脂肪肝発症と関連することを見出しました(iScience, 2024)。「個体差」といえばこれまではゲノム多型(SNPs)で語られることが多かったのですが、我々は、ゲノム多型であれエピゲノム修飾であれ結果として生じる生理機能に見られる個体差を指標とした「生理学的個体差」と疾患感受性の関連性に着目し、環境要因、特に概日リズム特性と生活習慣病の疾患感受性との関連メカニズムの解明を目指しています。
(3)予測と予防:ヒト概日リズムの調査・計測・評価

○「京都府内高校生ライフスタイル睡眠調査研究」
マウスやES/iPS細胞などを用いたメカニズム研究は、適正で良質な「科学的問い」がそのスタートになります。何が重要な問いであり、何が未解決課題なのか?我々は、常にこのような「問い」を自問自答しています。その際、何よりも重要になるのは、ヒトです。実社会において、概日リズム・体内時計が関与していると想定される健康課題は多岐に渡ります。しかも、その多くが未解決な「Unmet medical needs」となっています。実社会において人々の暮らしの中で、何が起こっているのかを把握することが重要となります。
我々は、これまで「京都府内高校生ライフスタイル睡眠調査研究」や「3交替制から2交替制への移行に伴う看護師調査」といったヒトを対象とした調査研究を実施してきました。これらの研究は、さまざまな仮説を与えてくれます。定性的研究であっても、基礎研究のテーマとなる「仮説生成」には極めて重要な道標を与えてくれます。
○ヒト概日リズム計測評価法の確立
単なる睡眠質問票やアンケート調査だけでなく、自律神経活動や体温リズム、睡眠リズムなど生理機能の計測評価を加えることで、ライフスタイルと生理機能の動的恒常性との関連性を明らかにすることを目指しています。睡眠覚醒リズムは、もちろん、概日リズムと関連があり重要な指標となります。しかし、概日リズムは、全身の体内時計の同期によって制御される多臓器連関による恒常性維持機構であり、独立したいくつかの生理機能リズムを指標とした解析評価が必須となります。我々は、自律神経活動、深部体温、メラトニンやコルチゾールなどの連続計測を組み合わせ、細胞から臓器・全身レベルの「同期」を定量的に評価する技術を開発しています。
また、基礎研究から得られた結果の解釈の際、ヒトでの観察結果は非常に有用な示唆を与えてくれます。このような基礎研究とヒト研究のサイクルにより、我々は、より精度の高いリスク予測と予防法確立によって生涯にわたる健康を実現する「生涯健康医学」を展開しています。




